doi: 10.62486/agmu202447
REVISIÓN
¿Guillain Barre syndrome and inadequate secretion of antidiuretic hormone, is their relationship possible?
¿Síndrome de Guillain Barre y de secreción inadecuada de la hormona antidiurética, es posible su relación?
Carmen Laura Garcés Hazou1
![]() *,
Rommer Alex Ortega Martinez2
*,
Rommer Alex Ortega Martinez2
![]() *,
Giovana Marleny Sanabria García3
*,
Giovana Marleny Sanabria García3
![]() *
*
1Hospital Obrero Nro. 2, Caja Nacional de Salud. Cochabamba, Bolivia.
2Universidad Privada del Valle. Hospital Obrero Nro. 2, Caja Nacional de Salud. Cochabamba, Bolivia.
3Universidad Privada del Valle. Cochabamba, Bolivia.
Citar como: Garcés Hazou CL, Ortega Martinez RA, Sanabria García GM. ¿Guillain Barre syndrome and inadequate secretion of antidiuretic hormone, is their relationship possible? Multidisciplinar (Montevideo). 2024; 2:47. https://doi.org/10.62486/agmu202447
Enviado: 11-10-2023 Revisado: 10-02-2024 Aceptado: 30-08-2024 Publicado: 31-08-2024
Editor: Telmo Raúl
Aveiro-Róbalo ![]()
ABSTRACT
Guillain-Barré syndrome (GBS) is a polyradiculoneuropathy of acute onset and the most common cause of acute flaccid paralysis. It is characterized by the appearance of sensory and/or motor symptoms, accompanied by a decrease or absence of muscle stretch reflexes and other symptoms such as facial paralysis, altered eye movements, bulbar symptoms, altered wakefulness, dysautonomia and ataxia. On the other hand, hydroelectrolyte disorders are associated with serious neurological diseases as a poor prognostic factor; the most affected electrolyte is sodium; in fact, hyponatremia is the most common disorder in hospitalized patients, regardless of the cause; in GBS, it is a frequent finding on admission. It is important to recognize hyponatremia, due to its high morbidity and mortality; it is also a marker of an underlying disease. Syndrome of inappropriate secretion of antidiuretic hormone (SSIADH) is the most common cause of hyponatremia and has been associated with Guillain Barre syndrome; in this way, its diagnosis is a challenge for the doctor; finally, below we describe details of a 70-year-old male patient who was admitted to the intensive care unit, with hyponatremia with a SSIHAD, with good subsequent evolution.
Keywords: Guillain Barre Syndrome; Hyponatremia; Hydroelectrolyte Imbalance; Inappropriate ADH Secretion Syndrome.
RESUMEN
El síndrome de Guillain-Barré (SGB) es una polirradiculoneuropatía de inicio agudo y la causa más común de parálisis fláccida aguda, este se caracteriza por la aparición de síntomas sensitivos y/o motores, acompañados de disminución o ausencia de reflejos de estiramiento muscular y otros síntomas como parálisis facial, alteración de los movimientos oculares, síntomas bulbares, alteración del estado de vigilia, disautonomía y ataxia. Por otro lado, los trastornos hidroelectrolíticos se asocian con enfermedades neurológicas graves como factor de mal pronóstico; el electrolito más afectado es el sodio; de hecho, la hiponatremia es el trastorno más común en pacientes hospitalizados, independientemente de la causa; en el SGB, al ingreso es un hallazgo frecuente. Es importante reconocer a la hiponatremia, debido a su morbilidad y mortalidad elevada; además es un marcador de una enfermedad subyacente. El síndrome de secreción inadecuada de hormona antidiurética (SSIADH) es la causa más frecuente de hiponatremia y se ha visto asociada al síndrome de Guillain Barre; de esta manera, su diagnóstico es un desafío para el médico; finalmente a continuación se describen detalles de un paciente varón de 70 años que ingreso a la unidad de terapia intensiva, con hiponatremia con un SSIHAD, con buena evolución posterior.
Palabras clave: Desequilibrio Hidroelectrolítico; Hiponatremia; Síndrome de Guillain Barre; Síndrome de Secreción Inadecuada de ADH.
INTRODUCCIÓN
El síndrome de Guillain-Barré (SGB) se considera la causa más frecuente de parálisis flácida aguda,(1) con una incidencia mundial de 0,6 a 4 por 100 000 habitantes y en américa latina la incidencia anual varía entre 0,40 a 2,12 por 100 000 personas por año,(2) es una de las indicaciones de ingreso a la unidad de terapia intensiva (UTI); esta causado por una respuesta inmune aberrante, secundaria a una infección previa que daña los nervios periféricos, algunos de los criterios diagnósticos se describen en la figura 1.(3)
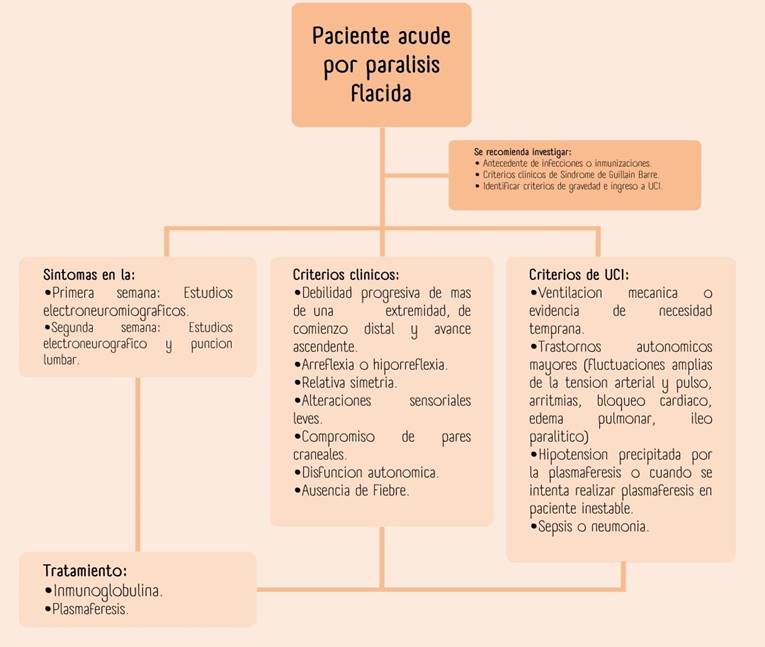
Figura 1. Extraído y modificado de guía y tratamiento de Guillain Barre en segundo y tercer nivel de atención. Instituto Mexicano de Seguro Social, 2016.(16)
Desde otra óptica, la hiponatremia es el trastorno más común en pacientes hospitalizados con una incidencia de 15 a 30 %; de esta manera, el síndrome de secreción inadecuada de hormona antidiurética (SSIHAD) es una de las causas más comunes de hiponatremia en la terapia intensiva, representa el 46 % de los casos de hiponatremia.(4) El SSIHAD fue diagnosticado por primera vez en 1957 por Schwartz y enumeraron los principales síntomas como hiposmolaridad plasmática, osmolaridad plasmática superior a osmolaridad urinaria, excreción renal de sodio excesiva y ausencia de factores clínicos causantes de edema o depleción de volumen, función renal y adrenal normales.(8,9,10,11,12) Se describió por primera vez en pacientes con carcinoma broncogénico, en quienes se detectó un estímulo fisiológico por la falta de la liberación de la hormona antidiurética (HAD); la cual es sintetizada en los núcleos paraventriculares y supraópticos del hipotálamo y posteriormente transportada por los axones hasta la neurohipófisis donde se almacena y se libera;(5) por lo tanto, el nivel de secreción de la hormona antidiurética se consideró inapropiado.(6)
El SSIHAD es una complicación reconocida del SGB, en un estudio prospectivo de SSIHAD en SGB, de 50 pacientes, el 48 % tuvo SSIHAD en alguna etapa de su enfermedad y la mediana de tiempo de aparición fue de 8,8 días después de su diagnóstico, en la mayoría de los casos, la hiponatremia ocurrió después de que se estableció el diagnóstico de SGB.(7) El tratamiento de la hiponatremia plantea un desafío en pacientes con SGB, especialmente en el contexto de disfunción autonómica asociada; en varios informes previos se han documentado una asociación del SSIHAD con el SGB, empero hay datos limitados en la literatura sobre las características de esta asociación.(8) Con el tratamiento de inmunoglobulina humana, un efecto secundario es el desarrollo de alteraciones hidroelectrolíticas, tales como la hiponatremia, la cual corresponde a una pseudohiponatremia caracterizada por la elevación de los lípidos y proteínas plasmáticas que determinan una reducción en la fracción acuosa del plasma y puede presentarse en el SGB.(9)
La hiponatremia, definida como un exceso de agua en relación con el sodio, se clasifica en hiponatremia leve (sodio sérico, 130-134 mmol/litro) ocurre en 15 al 22 % de estos pacientes y en aproximadamente el 7 % de los pacientes ambulatorios; la hiponatremia moderada (sodio sérico, 125-129 mmol/litro) ocurre en 1 al 7 % de los pacientes hospitalizados y la severa < a 125 mmol/litro con valores similares.(6) La hiponatremia puede surgir en distintos estados de tonicidad; con una osmolaridad sérica efectiva de 275 a 295 mOsm/kg es compatible con una hiponatremia isotónica o pseudohiponatremia, la hiponatremia combinada con una tonicidad plasmática mayor a 295mOsm/kg es indicativa de hiponatremia hipertónica y la hiponatremia hipotónica ocurre con una osmolaridad sérica menor a 275mOsm/kg. La hiponatremia hipotónica se divide en hipovolémica donde la hipoperfusión es significativa y genera un estímulo no osmótico para la liberación de vasopresina; por otro lado, la hipervolemia puede ser consecuencia de una insuficiencia cardiaca descompensada, falla renal o de una cirrosis avanzada y finalmente la euvolemica por una secreción persistente de vasopresina en ausencia de un estímulo osmótico o hemodinámico (figura 2).(10)

Figura 2. Extraído y modificado de “Diagnóstico y manejo de hiponatremia, una revisión”; 2022.(11)
El SSIHAD es la causa más frecuente de hiponatremia hipotónica euvolemica y se caracteriza por la secreción continua o aumento de actividad de la hormona arginina-vasopressina (HAV-HAD), la cual actúa en la regulación del equilibrio hídrico, además es un potente vasoconstrictor; tenemos tres receptores arginina-vasopresina: V1a, V1b y V2; la acción vasoconstrictora de la HAD se da gracias a los receptores (V1), en las arteriolas periféricas; la acción antidiurética resulta de la unión HAD a los receptores V2 en las células principales de los conductos colectores renales, de esta manera promueven la exposición de canales de agua (acuaporinas 2) en la membrana celular, aumentando así la permeabilidad, provocando retención de agua y reduciendo el volumen urinario.(5) La secreción hormonal es estimulada por el aumento de la osmolalidad plasmática, cuando hay un aumento de sólo el 1 % en la osmolaridad, los osmorreceptores hipotalámicos se deshidratan, provocando una sensación de sed y estimulan la liberación de HAD desde la hipófisis posterior; el exceso de HAD provoca retención de agua e hipervolemia, lo que inhibe la acción del sistema renina angiotensina-aldosterona (SRAA), aumentando la natriuresis, en consecuencia hay hiponatremia, disminución de la osmolalidad plasmática y aumento de la osmolalidad urinaria; fisiopatológicamente el SSIHAD; se entiende por un daño a las células hipotalámicas, provocando la fuga de hormona antidiurética (ADH) a la circulación sistémica.(10,11,12,13,14) Desde otra óptica, la interleucina 6 (IL-6) ha sido implicada en la patogénesis del SSIHAD en el SGB; esta es una citoquina inflamatoria que puede aumentar la liberación de vasopresina; activa el órgano subfornical y el órgano vasculoso de la lámina terminal, estimulando la sed y aumenta la secreción de vasopresina de los núcleos supraóptico y paraventricular.(5,6,7)
Los síntomas de la hiponatremia varían desde leves e inespecíficos (debilidad, náuseas, dolor de cabeza) hasta graves y potencialmente mortales (vómitos, somnolencia, convulsiones, dificultad cardiorrespiratoria).(14) La hiponatremia aguda grave puede asociarse con hernia cerebral, paro respiratorio, daño cerebral permanente y muerte;(11) su corrección se realiza con la infusión de 100 ml de NaCl al 3 % en forma de bolo, cuando el paciente se encuentre sintomático y el procedimiento se puede repetir con un intervalo de 10 minutos, esto promueve un rápido aumento de 2 a 4 mmol/L en los valores plasmáticos de Na y los síntomas se resuelven en la mayoría de los casos; si es necesario se continuara con una dosis de mantenimiento hasta subir de 8 o 10 mmol en 24 horas. En casos de hiponatremia crónica leve, el tratamiento consiste en la restricción de líquidos a 500 y 1000 ml/24 h, para inducir un balance hídrico negativo y aumentar la osmolalidad plasmática y los niveles séricos de sodio alrededor de 2 a 4 mEq/ L por día; se puede utilizar una infusión de soluciones salinas isotónicas o hipertónicas para corregir la hiponatremia en casos refractarios a la restricción hídrica o en presencia de síntomas de moderados a graves.(12)
La regulación de la HAD, mediada por el hipotálamo y las fibras nerviosas autónomas, puede verse alterada en el SGB debido al proceso autoinmune que conduce a patrones de liberación alterados de la hormona, provocando así el SSIHAD; en un estudio prospectivo en el que participaron 50 pacientes diagnosticados de SGB, se observó hiponatremia en el 48 % de los casos y en todos ellos la disfunción motora precedió a la aparición de hiponatremia; hay otras explicaciones para la patogénesis de la hiponatremia en el SGB, que incluyen deterioro de la función nerviosa autónoma que involucra las fibras aferentes de los receptores de estiramiento vascular, reinicio del osmostato, mayor sensibilidad de los receptores de HAD del túbulo distal y de los conductos colectores, y también mecanismos independientes de HAD (tabla 1).(13,17)
|
Tabla 1. Criterios diagnósticos y datos clínicos consistentes con el SSIHAD |
|
Criterios de Bartter y Schwartz para SSIHAD |
|
· Hiponatremia hipotónica (mOsm efectiva menor 275 mOsm/kg/H2O). · Euvolemia. · Orina menos diluida que la máxima (mOsm mayor a 100 mOsm/kg H2O). · Excreción elevada de sodio en orina proporcional a la falta de retención de sodio durante la ingesta normal de sodio y agua (mayor a 30 mEq/L). · Ausencia de enfermedad renal avanzada, cirrosis o enfermedades cardiacas. · Ausencia de causas alternativas de hiponatremia hipotónica euvolemica con orina diluida menos que la máxima, incluidos entre otros, hipotiroidismo, insuficiencia de glucocorticoides o uso de diuréticos.
Datos adicionales que respaldan el diagnóstico de SSIHAD · Ácido Úrico sérico mayor a 4 mg/dl. · Excreción fraccionada de ácido úrico mayor a 10 % · Empeoramiento de la hiponatremia en solución salina normal intravenosa. · Nivel de vasopresina o copeptina en plasma inapropiadamente elevado en relación con la osmolaridad sérica. · Respuesta anormal a la carga de agua (excreción menor de 80 % de una carga de 20ml/kg en 4h sin diluir la orina con menor 100mOsm/kg H2O. |
|
Fuente: Extraído y modificado de “Diagnóstico y tratamiento de los trastornos de la tonicidad corporal: hiponatremia e hipernatremia: plan de estudios básico”; 2020.(10) |
Tomando en cuenta la falta de información verídica y clara, sobre todo a nivel local, el objetivo de la presentación de este caso clínico es revelar la posible relación del SGB, la hiponatremia y el SSIHAD.
REPORTE DE CASO
Paciente masculino de 70 años, que ingreso al hospital en fecha 25/02/24, por el servicio de emergencias, con un cuadro clínico de un día de evolución, caracterizado por presentar paresia de miembros inferiores, que asciende a la cadera y a miembros superiores; entre sus antecedentes destaca el síndrome de Guillain Barre (SGB), diagnosticado en marzo del 2021, requirió ingresar a la unidad de cuidados intensivos (UCI) durante 6 días y recibió tratamiento con inmunoglobulinas® (IgIV); además, refiere hipertensión arterial y apendicetomía convencional en marzo del 2020. Durante su hospitalización, fue valorado por el servicio de neurología, y con la sospecha de una polirradiculoneuropatia tipo SGB, inician tratamiento con IgIV a 0,4 g/kg/día, 5 frascos (5 gr/100ml) por día, durante 5 días; en forma posterior el paciente presento mayor deterioro del estado general, más compromiso motor, sobre todo a nivel de los músculos respiratorios, por lo que fue evaluado por la UCI; hallando al paciente con escasa fuerza muscular en miembros inferiores y superiores, puntaje 2/5 según la escala de Daniels (evaluación cuantitativa de la fuerza muscular, desde una parálisis completa hasta una capacidad plena de movimiento con resistencia), además, presento mal manejo de secreciones y mala mecánica ventilatoria logrando una SatO2 de 82 % (2 L/min), motivo por el cual es admitido a la UCI.
En UCI, se lo encontró consiente, orientado y obedeciendo ordenes sencillas, por otro lado, presento debilidad en miembros superiores, sin poder flexionar codos, ni movilizar la cintura escapular, de la misma forma a nivel pélvico; además presenta mal manejo de secreciones; signos vitales con PA: 153/99 mmHg, PAM: 120 mmHg, FC: 75 lpm, FR: 24 rpm, SatO2: 94 % (FiO2 50 %) y T: 36,6ºC; inmediatamente se procede a proteger la vía aérea con intubación orotraqueal bajo laringoscopia directa, se conecta al ventilador mecánico, posteriormente se realiza la colocación de catéter venoso central e inicia analgosedación y se realizan exámenes complementarios. Al control laboratorial el paciente con Sodio de 133 mEq/L, potasio de 4,2 mEq/L y cloro de 101 mEq/L; gasometría arterial con pH: 7.32, PCO2: 39,1, PO2: 81,8, HCO3: 20,5, EB: -5,7, SatO2: 95 %, perfil renal con creatinina de 0,9 mg/dl y BUN de 8 mg/dl. La evolución posterior se caracterizó por permanecer bajo asistencia respiratoria mecánica, estable hemodinámicamente con pequeño apoyo vasopresor e inmunoglobulina. El control laboratorial periódico revela una hiponatremia hipotónica euvolemica (128 mEq/L) pese a la administración de solución salina hipertónica al 3% y correcciones según formula de déficit de sodio (Na) (Na ideal – Na actual) x Agua corporal total (ACT) (65 K): 390 mEq/L; en paralelo se aplicó la fórmula de Adrogue-Madias para su reposición (Na perfundido-Na real) /ACT+1, llegando a un valor de 9.7 mEq/L por día, sin embargo, la misma permaneció baja aproximadamente por 4 días (figura 3).
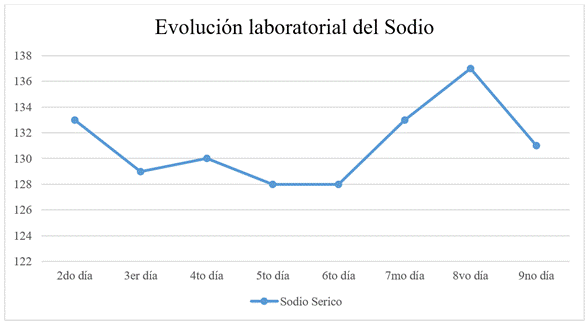
Figura 3. Evolución laboratorial del Sodio sérico (mEq/L)
En relación con la función motora, permaneció bajo terapia de rehabilitación y escasa evolución; presento un destete dificultoso de la asistencia respiratoria mecánica, por lo que fue sometido a una traqueostomía percutánea; desde otra perspectiva se solicita control de electrolitos (4to dia), Na: 130 mEq/L , K: 4,2 mEq/L, y Cl: 98 mEq/L además de electrolitos en orina que reporta Na: 66,2 mmol/L, K: 39,3 mmol/L, Cl: 50,1 mmol/L, con osmolaridad urinaria estimada de 221,53 mOsm/kg, compatible con una hiponatremia euvolemica (SSIHAD). Posteriormente se realiza una electromiografía, que reporta signos de lesión neurogénica axonal aguda sensitiva motora tipo guillen barre sthroll (AMSAN). En los días posteriores y bajo estricto apoyo de fisioterapia de rehabilitación, el paciente retoma la movilidad en miembros inferiores y cintura escapular; se progresa a ventilación espontanea, hasta su posterior retiro de la ventilación mecánica; finalmente es dado de alta en fecha 15/03/2024 a la unidad de cuidados intermedios de medicina, lugar donde permanece durante algunas semanas logrando su decanulación y es dado de alta a salas generales para seguimiento, manejo por neurología y posterior alta domiciliaria en los primeros días de abril del 2024.
DISCUSIÓN
El SGB es una polirradiculoneuropatía de inicio agudo que ocasiona parálisis flácida, con síntomas sensitivos y/o motores, acompañados de disminución o ausencia de reflejos osteo tendinosos y otros síntomas como parálisis facial, hasta compromiso respiratorio, como ocurrió en nuestro paciente; por otro lado, los trastornos hidroelectrolíticos se asocian frecuentemente con enfermedades neurológicas graves, el electrolito más afectado es el sodio; de hecho, su hallazgo es frecuente en el SGB;(14) la aparición de la hiponatremia puede ocurrir entre los 8 a 10 días luego del diagnóstico del SGB, como lo indica James et al.(7) en un caso clínico del 2017, donde además se menciona que el nivel de hiponatremia se relaciona con la gravedad del SGB; en consecuencia, nuestro caso ya ingreso con una hiponatremia moderada que llego a 128 mEq/L y además no presento grandes síntomas; desde otra óptica, en el caso de James et al.(7) se recuperaron sus valores del Na al 4to o 5to día, evolución similar a nuestro caso. De esta manera, la falta de información, refleja múltiples teorías, como la natriuresis, retención de agua y así un aumento de la permeabilidad, donde la HAD se une a la vasopresina 2 y produce un aumento de monofosfato de adenosina cíclico, activando la proteína quinasa y produce una translocación de vesículas perforadas que contienen acuaporinas 2 y van hacia la membrana apical por el citoesqueleto; la inervación exocitica hace que la membrana sea permeable al agua, el agua tubular ahora se puede mover hacia el intersticio gracias a los canales de basolaterales acuaporina 5 AQP5 y acuaporina 4 AQP4.(10)
Desde otra perspectiva, el control osmótico y no osmótico de la secreción de la HAD, es producida por los núcleos paraventricular y supraóptico del hipotálamo que pueden llegar a tener algún tipo de daño, en asociación con algunos marcadores inflamatorios como la IL-6; la respuesta osmótica al aumento de la secreción de ADH se produce con pequeño aumento en la osmolalidad plasmática; las neuronas sensoriales responden a cambios de la osmolalidad plasmática con cambios inversamente proporcionales en el volumen celular, de esta manera las células se encogen en forma de respuesta, activando la cascada de señalización y produce la liberación de HAD; por otro lado, la respuesta a la sed es detectada por neuronas en el núcleo ventromedial, desencadenando la liberación de HAD.(15) El SSIHAD está relacionado con la hiponatremia, inicialmente los pacientes son asintomáticos, pero cuando la concentración sérica de sodio es inferior a 125 mEq/L, pueden aparecer síntomas leves como nauseas, dolor de cabeza, mialgia, malestar general, hiporexia, confusión mental, reducción de los reflejos; en el caso nuestro descendió hasta 128 mEq/L sin síntomas graves;(12) si el SGB precede al SSIHAD es necesario realizar una pesquisa prolija de antecedentes y otras causas; en nuestro caso se tuvo precaución al momento de realizar el diagnostico ya que el origen del SSIHAD e hiponatremia persistente no tuvieron mucha certidumbre y tuvo que descartarse antecedentes de enfermedad febril y otros.(15)
Los factores que obligan a tratar el SSIHAD son la gravedad de la hiponatremia, su duración y la presencia o ausencia de síntomas; para pacientes sintomáticos con hiponatremia grave que se desarrolló dentro de las 48 horas, la experiencia clínica sugiere un tratamiento rápido; el objetivo es aumentar el nivel de sodio sérico de 4 mEq/L a 6 mEq/L en 1 a 2 horas, mediante la infusión de solución salina al 3 %; en nuestro paciente el objetivo del tratamiento estribo en la administración de mantenimiento de Na al 3 % sin exceder lo recomendado (10 mEq/L/día).(6) Por otro lado, la restricción de líquidos es la base del tratamiento; empero no muy enfocado en nuestro paciente; existen otros tratamientos como la administración de urea oral o enteral (15 a 60 g/día), aumenta la concentración sérica de sodio al promover la diuresis hídrica; 30 g de urea (500 mOsm) se asocian a 1 litro de excreción de agua cuando la osmolalidad de la orina es de 500 mOsm/kg; la terapia con urea se puede sustituir por tabletas de cloruro de sodio y furosemida o vaptanos. Desde otra óptica, los pacientes con SSIHAD suelen tener una ingesta baja de proteínas y aumentar la ingesta diaria de estas a 1 g/kg mejora la hiponatremia.(10) Los vaptanos (antagonistas del receptor de vasopresina) bloquean el receptor de vasopresina 2 ubicado en el conducto colector y promueven la diuresis del agua; donde el conivaptán (una preparación intravenosa) también bloquea el receptor de vasopresina y se asocia con hipotensión hasta en el 14 % de los pacientes; no se recomienda un tratamiento más prolongado debido a las interacciones con fármacos que también se metabolizan por la isoenzima hepática CYP3A4, como simvastatina, amlodipino y ketoconazol; en nuestro medio aun no contamos con estas alternativas, sin embargo el sospechar esta patología es un reto para el personal medico.(11,17)
El síndrome de Guillain Barre es una polineuropatía aguda, que puede ocurrir a cualquier edad y sobre todo en los varones; su tratamiento con inmunoglobulina humana resulta eficaz en la mayoría de los casos, sin embargo, un reporte mínimo de casos destaca la asociación de esta con la hiponatremia, como en el caso de nuestro paciente, donde al descartar las posibles causas de hiponatremia en SGB nos lleva a catalogarla como una hiponatremia hipotónica euvolemica, tipo SSIHAD, que puede ocurrir durante o después del déficit motor en un 30 % de los pacientes con SGB y generalmente 65 % de los casos de disautonomía; las fibras aferentes viscerales pueden estar afectadas juntamente con la disfunción autonómica y fibras parasimpáticas o simpáticas, conllevando a una insuficiencia simpática y parasimpática y la hiperactividad asociada con la neuropatía; estos factores combinados con los receptores de tensión vascular que afectan a las fibras autonómicas periféricas causan la secreción anormal de ADH a partir de la neurohipófisis y reducen los efectos de la inhibición vagal; de esta manera, la patogénesis del SSIHAD relacionada con el SGB aún es incierta, una de las hipótesis es que puede estar asociada con las respuesta alterada del osmorreceptor a nivel central.(10,11,12,13,14,15)
Actualmente existen escasos datos publicados en la literatura sobre la relación entre el SSIHAD desarrollado por SGB, por lo que recomendamos vigilar los niveles de sodio en pacientes con guillain barre y realizar el diagnostico diferencial entre la seudohiponatremia. y el SSIHAD; por otro lado, se deben considerar las estrategias de tratamiento, haciendo énfasis en la administración de inmunoglobulina humana y la aparición del SSIHAD.
REFERENCIAS BIBLIOGRÁFICAS
1. González Rabelino G. Parálisis flácida en la infancia. Arch. Pediatr. Urug. [Internet]. 2006 Oct [consultado el 10 de mayo del 2024] ; 77( 3 ): 308-312. Disponible en: http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S1688-12492006000300017&lng=es
2. Cui H, He G, Yang S, Lv Y, Jiang Z, Gang X, Wang G. Inappropriate Antidiuretic Hormone Secretion and Cerebral Salt-Wasting Syndromes in Neurological Patients. Front Neurosci. [Internet]. 2019 Nov 8 [consultado el 10 de mayo del 2024];13:1170. Disponible en: doi: 10.3389/fnins.2019.01170
3. Expósito J, Carrera L, Natera D, Nolasco G, Nascimiento A, Ortez C. Síndrome de Guillain-Barré y otras neuropatías autoinmunes: tratamiento actual [Guillain-Barré syndrome and other autoimmune neurophaties: current therapy]. Medicina (B Aires) [Internet]. 2022 Aug 30 [consultado el 10 de mayo del 2024]; 82 Suppl 3:82-88. Disponible en: https://pubmed.ncbi.nlm.nih.gov/36054864/
4. Martin-Grace J, Tomkins M, O’Reilly MW, Thompson CJ, Sherlock M. Approach to the Patient: Hyponatremia and the Syndrome of Inappropriate Antidiuresis (SIAD). The Journal of Clinical Endocrinology & Metabolism [Internet]. el 14 de julio de 2022 [consultado el 8 de mayo de 2024];107(8):2362–76. Disponible en: https://academic.oup.com/jcem/article/107/8/2362/6578514
5. Ortiz-Flores AE, Araujo-Castro M, Pascual-Corrales E, Escobar-Morreale HF. Síndrome de secreción inadecuada de hormona antidiurética. Medicine - Programa de Formación Médica Continuada Acreditado [Internet]. octubre de 2020 [consultado el 20 de junio de 2024];13(18):1000–6. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0304541220302407
6. Ellison DH, Berl T. Clinical practice. The syndrome of inappropriate antidiuresis. N Engl J Med [Internet]. 2007 May 17 [consultado el 20 de marzo de 2024];356(20):2064-72. Disponible en: doi: 10.1056/NEJMcp066837
7. James J. Syndrome of Inappropriate Secretion of Antidiuretic Hormone Preceding Guillain-Barré Syndrome. JCDR [Internet]. 2017 [consultado el 8 de mayo de 2024]; Disponible en: http://jcdr.net/article_fulltext.asp?issn=0973-709x&year=2017&volume=11&issue=9&page=OD16&issn=0973-709x&id=10662
8. Saifudheen K, Jose J, Gafoor VA, Musthafa M. Guillain-Barré syndrome and SIADH. Neurology [Internet]. el 22 de febrero de 2011 [consultado el 8 de mayo de 2024];76(8):701–4.: https://www.neurology.org/doi/10.1212/WNL.0b013e31820d8b40
9. Diaz G. Hiponatremia y terapia con inmunoglobulina endovenosa: a propósito de un paciente con síndrome de sobreposición. Rev. chil. reumatol; 27(2): 74-76, 2011.
10. Seay NW, Lehrich RW, Greenberg A. Diagnosis and Management of Disorders of Body Tonicity—Hyponatremia and Hypernatremia: Core Curriculum 2020. American Journal of Kidney Diseases [Internet]. febrero de 2020 [consultado e el 8 de mayo de 2024];75(2):272–86. https://linkinghub.elsevier.com/retrieve/pii/S0272638619309436
11. Adrogué HJ, Tucker BM, Madias NE. Diagnosis and Management of Hyponatremia: A Review. JAMA [Internet]. el 19 de julio de 2022 [consultado el 8 de mayo de 2024];328(3):280. Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2794358
12. Maruichi MD, Pai CYW, Amadeo G, Lopes RN, Tieppodos CA. Síndrome de secreción hormonal inadecuada. antidiurético. 13. Shah PM, Dhakre VW, Veerasuri R, Bhabhor A. Dysautonomia and hyponatraemia as harbingers of Guillain-Barre syndrome. BMJ Case Rep [Internet]. abril de 2019 [consultado el 8 de mayo de 2024];12(4):e226925. Disponible en: https://casereports.bmj.com/lookup/doi/10.1136/bcr-2018-226925
14. Martínez-Piña DA, Medina-Gómez V, García-Hernández JF, Vargas-Cañas ES, Violante-Villanueva A, López-Hernández JC. Guillain-Barre syndrome with hyponatremia, more than a simple finding. RMN [Internet]. el 16 de mayo de 2023 [consultado el 8 de mayo de 2024];24(3):10529. Disponible en: https://www.revmexneurociencia.com/frame_esp.php?id=217
15. Jones DP. Syndrome of Inappropriate Secretion of Antidiuretic Hormone and Hyponatremia. Pediatrics In Review [Internet]. el 1 de enero de 2018 [consultadoo el 8 de mayo de 2024];39(1):27–35. Disponible en: https://publications.aap.org/pediatricsinreview/article/39/1/27/35073/Syndrome-of-Inappropriate-Secretion-of
16. Çakırgöz MY, Duran E, Topuz C, Kara D, Turgut N, Türkmen ÜA, et al. Síndrome de secreción inapropiada de hormona antidiurética relacionado con el síndrome de Guillain-Barré tras colecistectomía laparoscópica. Brazilian Journal of Anesthesiology (Edicion en Espanol) [Internet]. mayo de 2014 [consultado el 8 de mayo de 2024];64(3):195–8. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S2255496313001335
17. Diagnóstico y tratamiento síndrome de Guillain-Barre, segundo y tercer nivel de atención. Instituto Mexicano de Seguridad Social. Dirección de prestaciones médicas. Unidad de atención médica. Guía práctica clínica. 2016. http://imss.gob.mx/profesionales-salud/gpc
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
FINANCIACIÓN
Los autores declaran que no recibieron financiación para el desarrollo del presente artículo.
CONTRIBUCIÓN DE LOS AUTORES
Conceptualización: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Análisis formal: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Investigación: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Supervisión: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Validación: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Visualización: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Redacción – borrador original: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.
Redacción – revisión y edición: Carmen Laura Garcés Hazou, Rommer Alex Ortega Martinez, Giovana Marleny Sanabria García.